Стабильность комплексов молчания, как было продемонстрировано с помощью прикрепления посредством метилированных гистоновых хвостов, по-видимому, является характерным признаком долговременной репрессивной функции PcG белков. однако при анализе
на клеточном уровне наблюдается удивительное динамическое поведение. Кластеры PcG белков в PcG тельцах, которые варьируют по размерам и составу, указывают на взаимодействие комплексов молчания в ядре онтогенетически регулируемым способом. Более того, динамический анализ
GFP-маркированных PC и PH белков выявил очень высокую скорость обмена несвязанных белков с их комплексами на молчащих мишенях (Ficz et al. 2005). Эти результаты указывают на то, что долговременная репрессия прежде всего базируется на химическом равновесии между связанными и несвязанными белками скорее, чем на защите с высоким сродством ДНК-связывающих сайтов.
Соединение PRCls с PREs, по-видимому, индуцируется исходно (default), т.к. многие компоненты прикрепления PcG и ДНК-связывающих белков экспрессируются во всех клетках, а PREs глобально замалчивают репортерные гены в трансгенных конструкциях. Противодействующие белки из trxG этого не делают, фактически, функционируя не как активаторы, а скорее как анти-репрессоры (Klymenko and Miiller 2004; see Chapter 12). Т.о., чтобы поддерживать активную транскрипцию PRE-контролируемых генов, молчание на этих PRE предупреждается ткане- и стадио-специфическим образом. У
Drosophila, напр., активация HOX генов контролируется с помощью раннего каскада транскрипционных факторов, кодируемых генами сегментации. Интересно, что эти факторы индуцируют транскрипцию не только HOX генов, но и также межгенных, некодирующих РНК, которые транскрибируются посредством ассоциированных PREs, и часто обнаруживаются иерархически выше или ниже (Fig. 5). Было продемонстрировано, что транскрипция посредством PREs необходима для предупреждения молчания и поддержания активного состояния репортерного гена, используемого в трансгенных конструкциях (Schmitt et al. 2005). Процесс транскрипции скорее всего ремоделирует PRE хроматин, чтобы генерировать активное состояние, характеризующееся, напр., отсутствием репрессивного метилирования гистонов и присутствием ацетилирования гистонов. Т.о., даже посредством ДНК-связывающих белков привлечение PRCl к этим специфически активированным PRE, гистоновое окружение не позволит прикрепиться PC посредством H3K27me3, и не будет возникать стабильное молчание. Т.к. молчание индуцируется исходно(default) в PcG системе, то эпигенетическое наследование паттерна дифференциальной экспрессии генов нуждается только в трансмиссии активного состояния PRE во время репликации ДНК и митозов (Fig. 7c). Как это достигается на молекулярном уровне и какие эпигенетические метки ответственны за поддержание активного состояния PRE, всё ещё открытый вопрос. Интересно, что недавно было показано, что в случае PRE
Drosophila из гомеозисного гена
Ubx некодирующие РНК, продуцируемые на PREs, остаются ассоциированными с хроматином и рекрутируют trxG регулятор Absent Small or Homeotic discs 1 (ASHl). Деструкция этих РНК с помощью RNAi ослабляет рекрутирование ASHl на PRE, указывая тем самым, что это взаимодействие играет важную роль в эпигенетической активации гомеозисных генов путем преодоления исходно индуцируемого с помощью PcG молчания (Sanchez-Eisner et al. 2006).
4 PcG Repression in Mammalian Development
4.1 From Cene to Chromosome Repression
Мутации в членах PRCl мышей вызывают гомеозисные трансформации осевого скелета. Это может быть связано с появлением дополнительных позвонков как следствие дерепрессии HOX генов (Fig. 2e,f) (Core et al. 1997). Кроме того, мутантные мыши обладают тяжелым комбинированным иммунодефицитом, вызываемым отсутствием пролиферативного ответа гематопоэтических клеток (Raaphorst 2005). Роль PcG белков была особенно тщательно исследована на клетках крови в свете того факта, что большинство клонов кровяных клеток характеризуется своей хорошо описанной транскрипционной программой, специфичной для данного типа клеток. Однако, клональная детерминация и ограничение так или иначе нуждаются в четком поддержании в ходе клеточных делений. Оказывается, что у PcG нокаутных мышей популяции B- и T-клеточных предшественников продуцируются нормально, указывая тем самым, что PcG контроль не участвует в установлении паттернов клон-специфичной генной экспрессии. PcG белки, однако, вносят вклад в необратимость клонального выбора скорее, чем в выбор определенного отногенетического пути.
Помимо контроля HOX генов, паттерны экспрессии которых характеризуют разные клоны кровяных клеток, PcG белки играют главную роль в контроле пролиферации. Ген bmil, ортолог Psc Drosophila был первоначально идентифицирован как онкоген, который в содружестве с myc, индуцирует у мышей lymphomagenesis (van Lohuizen et al. 1991). Белок Bmil контролирует регуляторы клеточного цикла pl6INK41 and pl9ARF (Jacobs et al. 1999). Bmil и родственный белок Mel-18 являются негативными регуляторами локуса INK4c-ARF, необходимого для контроля нормальной лимфоидной пролиферации. Неправильная регуляция этого важного checkpoint клеточного цикла влияет на апоптоз и старение мышей (Akasaka et al. 2001).
Белки PcG млекопитающих также ассоциированы с классическим эпигенетическим феноменом инактивации Х хромосом (see Chapter 17). Инактивация одной из Х хромосом в клетках самок XX сопровождается серией модификаций хроматина, которые используют PcG белки (Heard 2004). В частности, компоненты PRC2, такой как гомолог ESC, Eed (Embryonic ectoderm expression), или гомолог E(Z), Enxl (Table 1), играют главную роль в установлении гистоновых меток, ассоциированных с транскрипционным молчанием. Временная ассоциация этого PRC2 с Х хромосомой, покрытой Xist РНК, сопровождается метилированием H3K27. Напротив, eed мутантные эмбрионы мыши не обнаруживают ни рекрутирования Enxl HKMT, ни какого-либо метилирования H3K27. Однако, отсутствие этих компонентов PRC2 не ведет к полной дерепрессии всей неактивной Х хромосомы: скорее к спорадическому возобновлению экспрессии X-сцепленных генов и к увеличению эпигенетических меток, ассоциированных с активным состоянием (H3K9ac и H3K4me3) в некоторых клетках. Это скорее всего происходит из-за того, что др. частично перекрывающиеся эпигенетические механизмы действуют, чтобы гарантировать поддержание неактивности Х хромосомы.
Рекрутирование PRC2 на неактивную Х хромосому, по-видимому, зависит от Xist РНК. Т.к. ассоциация PRC2 с неактивной Х лишь временная, то возможно. что комплекс необходим только для установления эпигенетических меток (напр., H3K27me3) для поддержания молчания. Сегодня неизвестно, распознает ли непосредственно PRC1 эти метки и необходим ли для перманентного молчания неактивной Х хромосомы, но компоненты PRC1 обнаруживаются ассоциированными в неактивной Х хромосомой. Однако, метилирование ДНК, как известно, сопровождает фазу поддержания и необходимо для перманентной инактивации Х.
PRC2 специфически вовлекается в регуляцию моноаллельной экспрессии Х хромосомы как в эмбрионах, где инактивация Х хромосомы случайна, так и во внеэмбриональных тканях, где ирнактивируется всегда Х хромосома, унаследованная от отца (импринтированная инактивация Х хромосомы). Кроме того, недавно было установлено, что PRC2 участвует в регуляции некоторых аутосомных импринтируемых генов. Напр., анализ 14 импринтированных локусов из 6 несцепленных имприрнтируемых кластеров показал, что 4 из них биаллельно экспрессируются у eed мутантных мышей (Mager et al. 2003; for more detail, see Chapter 19). Интересно, что все локусы, которые теряют импринтированную экспрессию были нормально репрессированы, если наследовались от отцов, тогда как ни один из матерински репрессируемых локусов не затрагивался. Т.к. недавно было показано, что Ezh2 непосредственно взаимодействует с ДНК methyltransferases млекопитающих и необходим для их активности (Vire et al. 2006), оказалось возможным, что PRC2 играет роль в регуляции этих импринтируемых генов посредством метилирования ДНК (see Chapter 18).
Вовлечение PRC2 в регуляцию экспрессии импринтируемых генов описано также у Arabidospis, где локус PHE1 экспрессируется на более высоких уровнях с отцовского аллеля (Kohler et al. 2005). У мутантов по E(z) гомологу M2L4, материнский PHE1 аллель специфически дерепрессируется. Сходным образом MEA также регулирует свою собственную импринтируемую экспрессию: в раннем репродуктивном развитии материнский аллель MEA строго дерепрессирован у мутантов mea. Этот эффект, однако, независим от др. компонентов FIS комплекса (Baroux et al. 2006). Напротив, позднее в развитии FIS комплекс гарантирует стабильную репрессию отцовского аллеля MEA (Baroux et al. 2006; Gehring et al. 2006; Jullien et al. 2006). В этом последнем случае комплекс FIS участвует в молчании отцовских репрессируемых импринтируемых генов, сходно с ситуацией у млекопитающих. Кроме того, MEA также играет роль в поддержании экспрессии материнских PHE1 и MEA аллелей на низких уровнях (Fig. 4).
Т.к. компоненты PRC2 присутствуют у растений, беспозвоночных и млекопитающих, то PRC2 представляет собой родоначальный молекулярный модуль, необходимый для генной репрессии, которая уже присутствует у одноклеточных родоначальников растений и животных ещё до эволюции многоклеточности. Т.о.. эти примеры подтверждают, что PRC2 рекрутируется независимо для регуляции экспрессии импринтируемых генов у растений и млекопитающих, двух ветвей, где имеет место геномный импринтинг (Grossniklaus 2005).
4.2 Consequences of Aberrant Transcriptional Activation
Находка, что неправильная регуляция Bmil вызывает злокачественные лимфомы у мышей ставит вопрос, вносит ли BMI1 (компонент PRC1) человека сам по себе вклад в развитие рака сходным образом. Накапливаются доказательства, что измененная экспрессии PcG гена широко распространена в злокачественных лимфомах людей (Raaphorst 2005). Напр., уровень избыточной экспрессии BMI1 в B-клеточных лимфомах коррелирует со степенью злокачественности, подтверждая, что компоненты PRC1 играют роль в формировании раковых опухолей у людей. Однако, гены мишени для BMI1 в клетках человека, по-видимому, отличаются от тех, что в мышиных лимфоцитах, т.к. не обнаруживается явного подавления pl6INK4a, коррелирующего с избыточной экспрессией онкогена.
Избыточная экспрессия PcG наблюдается не только в гематологических злокачественных образованиях, но и также обнаруживается в твердых опухолях, включая medulloblastomas и опухоли, возникающие в печени, толстой кишке, грудных железа,легки, пенисе и простате (Fig. 8). Высокая экспрессия PRC2 маркера, Ezh2, часто обнаруживается на ранних стадиях высоко пролиферативных легочных сарком. Это указывает на то, что хорошо известный каскад инициации PRC2 iи поддержания PRC1 maintenance (Fig. 5) может также сопровождать развитие клонов опухолевых клеток.
Интересно, что компоненты PRC2 также играют критическую роль в контроле клеточной пролиферации у
Arabidopsis. Хотя аберрантный рост не ведет к раку и гибели растений, строгий контроль клеточной пролиферации является
 Figure 8. PRC2 Regulates Cell Proliferation in Mammals and Plants (a, b) Plant embryos derived from wild-type and mea mutant egg cells. MEA encodes a protein of the FIS complex and regulates cell proliferation. The giant mea embryo is much larger than the corresponding wild-type embryo at the same stage of development (late heart stage). Mutant embryos develop more slowly and have approximately twice the number of cell layers, (c, d) Normal and cancerous prostate epithelium. In the cancerous epithelium, Ezh2 expression is highly increased (labeled with an anti-Ezh2 antibody). Thus, both toss of E(Z) function in plants and overexpression of E(Z) function in humans can lead to defects in cell proliferation, (e, /) Control and RING1 overex-pressing rat la fibroblast cells. Overexpression of RING1 leads to anchorage-independent growth in soft agar, typical of neoplastically transformed cells. (a,b, Courtesy of J.-P. Vielle-Calzada and U. Gross-nikiaus; c,d, reprinted, with permission, from Kuzmichev et al. 2005 [©National Academy of Sciences; e,f, reprinted, with permission, from Satijn and Otte 1999 [©American Society for Microbiology].)
Figure 8. PRC2 Regulates Cell Proliferation in Mammals and Plants (a, b) Plant embryos derived from wild-type and mea mutant egg cells. MEA encodes a protein of the FIS complex and regulates cell proliferation. The giant mea embryo is much larger than the corresponding wild-type embryo at the same stage of development (late heart stage). Mutant embryos develop more slowly and have approximately twice the number of cell layers, (c, d) Normal and cancerous prostate epithelium. In the cancerous epithelium, Ezh2 expression is highly increased (labeled with an anti-Ezh2 antibody). Thus, both toss of E(Z) function in plants and overexpression of E(Z) function in humans can lead to defects in cell proliferation, (e, /) Control and RING1 overex-pressing rat la fibroblast cells. Overexpression of RING1 leads to anchorage-independent growth in soft agar, typical of neoplastically transformed cells. (a,b, Courtesy of J.-P. Vielle-Calzada and U. Gross-nikiaus; c,d, reprinted, with permission, from Kuzmichev et al. 2005 [©National Academy of Sciences; e,f, reprinted, with permission, from Satijn and Otte 1999 [©American Society for Microbiology].)
важным для нормального развития. У мутантов
fis класса два продукта оплодотворения цветущих растений, эмбрион и эндосперм, избыточно пролиферируют приводя в результате к прекращению развития семян (Fig. 8) (Grossniklaus et al. 2001; Hsieh et al. 2003; Guitton and Berger 2005). Эффекты на клеточную пролиферацию наблюдаются также у двойных мутантов
elf и swtiy двух растительных гомологов E(z). Такие растения обнаруживают нормальное развитие семян после оплодотворения, но продуцируют массу пролиферирующей, недифференцированной ткани (callus) скорее, чем листья (Chanvivattana et al. 2004).
Хотя неизвестно, как PRC2 контролирует клеточную пролиферацию у растений, скорее всего он использует взаимодействия с RBR1, растительным гомологом белка Retinoblastoma (Rb) (Ebel et al. 2004; Mosquna et al. 2004). Мутации генов класса FIS не только вызывают дефекты пролиферации во время развития семян после опыления, но и также необходимы для предупреждения пролиферации эндосперма в отсутствие оплодотворения. Этот последний аспект фенотипа является общим с
rbrl мутантами, это указывает на связь с Rb путем. Удивительно, но взаимодействие между Rb путем и PRC2 было также описано у млекопитающих (Bracken et al. 2003), это иллюстрирует консервацию регуляторных сетей между растениями и животными.
4.3 Maintaining Stem Cell Fate
Стволовые клетки играют всё увеличивающуюся роль в медицине. Их потенциал предоставлять предшественников для заживления поврежденрнях тканей делает их очень ценным инструментом регенеративной медицины. Не удивительно, что они довольно хороошо охарактеризованы для клонов кровяных клеток. Hematopoietic stem cells (HSCs) поддерживают пул кровяных клеток благодаря само-обновлению, а также за счет продукции дочерних клеток, которые дифференцируются в лимфоидные, миэлоидные и эритроидные клоны. Ниши стволовых клеток во взрослом костном мозге поставляют клетки со специфическими внешними сигналами для поддержания их судьбы. С др. стороны, внутренне присущие клеткам сигналы для поддержания "stem cellness" состояния, по-видимому, имеют отношение к PcG системе.
Мышиные мутации. затрагивающие гены PRC1 (напр., bmil/mel-18, mphl/rae28t и m33; see Table 1) страдают от различных дефектов гематопоэтической системы, таких как гиперплазия (т.e., повышенная клеточная пролиферация) в селезенке и тимусе, редукция B и T клеток и нарушенная пролиферативная реакция лимфоидных предшественников на цитокины. Потребность в Bmil и Mel-18 для само-обновления стволовых клеток во время различных стадий развития подтверждает изменяющийся пул генов мишеней между эмбриональными и взрослыми стволовыми клетками.
Система PcG необходима также для neural stem cells (NSCs), как указывают нейральные дефекты, обнаруживаемые у bmil мутантов мыши (Bruggeman et al. 2005; Zencak et al. 2005). В частности, мыши обнаруживали деплецию церебральных NSCs постнатально, что указывает на потребность in vivo Bmil для возобновления NSC. Как было установлено для гематопоэтической системы, очевидно, что поддержание эмбриональных NSC находится под контролем другой PcG сети, чем само-обновление NSC у взрослых.
Внешние сигналы, подобные сигнальному каскаду sonic-Hedgehog модулируют реакцию Bmil в NSCs и гарантируют proliferative/self-renewal способность (Leung et al. 2004). Идентификация этих внешних сигналов, контролирующих PcG репрессию, стала возможна благодаря анализу развития cerebellar granule neuron progenitors (CGNPs). Постнатальные волны пролиферации индуцируются благодаря передаче сигналов Sonic hedgehog (Shh), секретируемого клетками Пуркинье. Сигнал Shh разветвляется, чтобы контролировать N-Myc и Bmil уровни (Fig. 9). Т.о., Bmil-дефицитные CGNPs обнаруживают дефектную пролиферативную реакцию
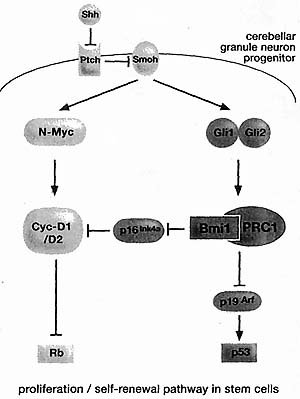 Figure 9. Sonic Hedgehog Signaling Maintains Proliferation/Self-renewal of Cerebellar Progenitor Cells
The Shh signaling cascade regulates both the Rb pathway and the p53 pathway via Bmil control of the pl6/p!9 proliferation checkpoint. Inhibition of Smoothened (Smoh) by the Shh receptor Patched (Ptch) results in downstream signaling in the nucleus. One part of the signal induces N-Myc, Cyclin D1, and D2, whereas the other part activates Bmil via the Gli effectors. (Adapted from Valk-Lingbeek et al. 2004.)
Figure 9. Sonic Hedgehog Signaling Maintains Proliferation/Self-renewal of Cerebellar Progenitor Cells
The Shh signaling cascade regulates both the Rb pathway and the p53 pathway via Bmil control of the pl6/p!9 proliferation checkpoint. Inhibition of Smoothened (Smoh) by the Shh receptor Patched (Ptch) results in downstream signaling in the nucleus. One part of the signal induces N-Myc, Cyclin D1, and D2, whereas the other part activates Bmil via the Gli effectors. (Adapted from Valk-Lingbeek et al. 2004.)
на стимуляцию Shh. Сигнал Shh способен контролировать пролиферацию этих стволовых клеток путем модулирования как нижестоящего Rb пути (посредством N-myc и Bmil/pl6
NK4a) так p53 пути (посредством Bmil/pi19
ARF). Этот механизм объясняет, почему гиперактивация передачи сигналов Shh ведет к развитию medulloblastomas (Leung et al. 2004). HSCs регулируются с помощью сходного Indian hedgehog-контролируемого пути. В NSCs экспрессия локусов
Hoxd8, Hoxd9 и Hoxc9 находится под контролем Bmil. Соотв. профиль HOX экспрессии обеспечивает необходимую судьбу стволовым клеткам.
В самом деле, т.к. стволовые клетки представляют собой определенную, детерминированную клеточную судьбу, то не удивительно, что PcG система поддерживает эти специфические судьбы митотически наследуемым способом. Пока неясно, играет ли PcG роль в поддержании стволовых клеток у растений. Предположительно, однако, репрограммирование растительных клеток, которые тотипотентны и обладают потенциалом формировать полный новый организм в соотв. условиях, д. использовать PcG регуляцию. В самом деле растения, лишенные E(z) гомологов CLF и SWN продуцируют массу недифференцированных клеток после оплодотворения, это указывает на то, что PcG необходимы для поддержания дифференцированного состояния (Chanvivattana et al. 2004).
5 Conclusion and Outlook
It has been remarkable to follow the development of our understanding of PcG epigenetic regulation from the initial genetic identification of a Drosophila mutant possessing additional sex combs on the second and third leg. This eventually led to the discovery of a new class of regulators found to be required for fundamental epigenetic processes such as vernalization in plants and silencing of the mammalian X chromosome. Control of genetic information is highly influenced by chromatin structure and composition of histones in their various modified forms. The proteins of the PcG are direcdy involved in generating epigenetic marks, for instance, H3K27me3, as a consequence of developmental decisions. The same group "reads" (i.e., shows high affinity to), through the action of the PRC1 proteins, these epigenetic marks and translates them into a stable, transcriptionally repressed state. In the model organism Drosophila, we have a relatively clear picture of how PcG complexes are anchored at PREs, for a defined group of target genes that are subject to long-term repression. However, to date, no PREs have been identified in other organisms. Although the basic function of PcG proteins remains the same, it is unclear which part of the plant and vertebrate genomes is subjected to their repression and how they are targeted to their site of action. Additionally, we need to get a better understanding of how an apparently dynamic group of proteins can impose a stable state of transcriptional repression through a chemical equilibrium.
The other major question of the PcG research focuses on the heritability of the repressed state, the very essence of epigenetics. What is the identity of the molecular marks required to transmit a state of gene expression through DNA replication and mitosis? We know that the cooperation of trxG and PcG proteins maintains active or silent states of gene expression. Do both states need a corresponding epigenetic mark that is transmitted to daughter cells, or is only one sufficient, while the other represents the default state? The mechanism by which PcG proteins impose silencing on transcription during the interphase of the cell cycle has become increasingly clear. In the future, the focus of research will be on how the information regarding a state of gene expression endures the DNA replication process and is faithfully transmitted to the daughter cells following mitosis.
Сайт создан в системе
uCoz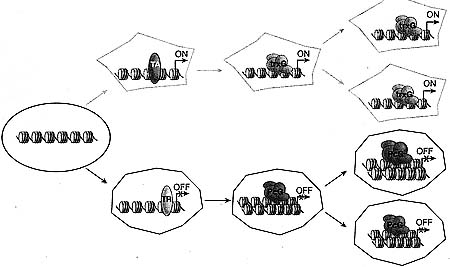 Figure 1. The Concept of Cellular Memory
Schematic illustration of the involvement of PcG and trxG complexes in the determination of active and repressed states of gene expression and, thereby, cellular differentiation, which is maintained over many cell divisions. (TA) Transcriptional activator; (TR) transrciptional repressor.
Figure 1. The Concept of Cellular Memory
Schematic illustration of the involvement of PcG and trxG complexes in the determination of active and repressed states of gene expression and, thereby, cellular differentiation, which is maintained over many cell divisions. (TA) Transcriptional activator; (TR) transrciptional repressor. 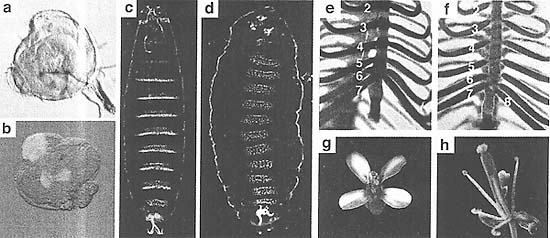
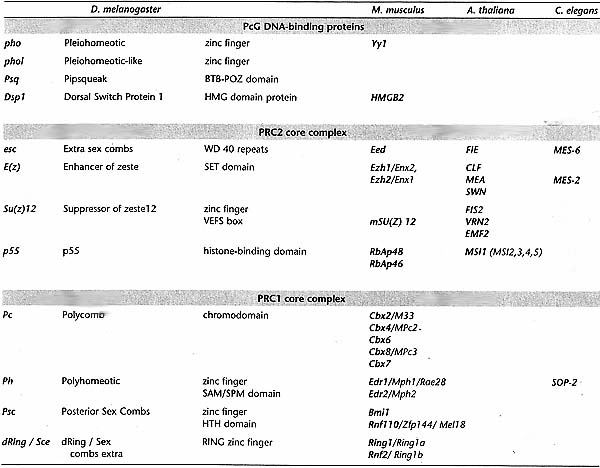
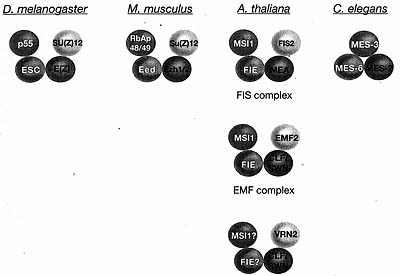 Figure 3. Conserved PRC2 Core Complexes
The core members of PRC2 in D. melanogaster, M. musculus, A. thaliana, and C elegans are shown. In A. thaliana, an ancestral complex is proposed to have diversified into three variants with discrete functions in development. In C. elegans, the PRC2 core complex contains only three proteins: MES-3 does not have homology with any other identified PRC2 protein. The colors indicate homology, the contacts indicate interactions. (Adapted from Reyes and Grossniklaus 2003 and Chanvivattana et al. 2004.)
Figure 3. Conserved PRC2 Core Complexes
The core members of PRC2 in D. melanogaster, M. musculus, A. thaliana, and C elegans are shown. In A. thaliana, an ancestral complex is proposed to have diversified into three variants with discrete functions in development. In C. elegans, the PRC2 core complex contains only three proteins: MES-3 does not have homology with any other identified PRC2 protein. The colors indicate homology, the contacts indicate interactions. (Adapted from Reyes and Grossniklaus 2003 and Chanvivattana et al. 2004.) 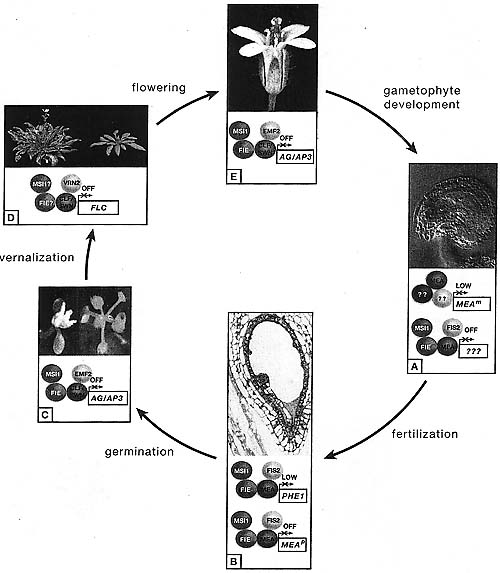
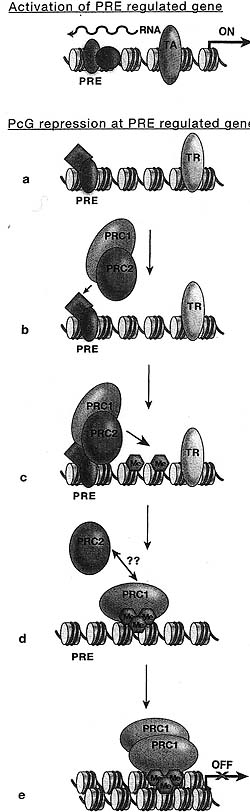 Figure 5. Sequence of Events Leading to the PcC-dependent Repressed State of Gene Expression in Drosophila Embryos
The original gene expression state of a PRE-regulated gene is determined by the activity of transcriptional regulators, either transcriptional repressors (TR) or activators (TA). Transcription through the PRE prevents the establishment of the "OFF" state and leads to the trxG-dependent "ON" state (for details, see Fig. 8 in Chapter 12). (o-b) A nontranscribed PRE binds specific DNA-binding proteins (e.g., PHO, PHOL, DSP1, or GAF) that are involved in the recruitment of the early PcG complex containing proteins of both PRC1 and PRC2. (c) This early PcG complex marks chromatin by E(Z)-dependent histone methylation. (d) Maintenance of the silent state occurs through interactions of the two distinct complexes, PRC1 and PRC2, in the absence of the original transcriptional repressor. Maintenance of PRC! is stabilized through binding of H3K27me3 via the chromodomain of PC. (e) PRC1 can compact chromatin, further establishing tightly condensed, silent chromatin.
Figure 5. Sequence of Events Leading to the PcC-dependent Repressed State of Gene Expression in Drosophila Embryos
The original gene expression state of a PRE-regulated gene is determined by the activity of transcriptional regulators, either transcriptional repressors (TR) or activators (TA). Transcription through the PRE prevents the establishment of the "OFF" state and leads to the trxG-dependent "ON" state (for details, see Fig. 8 in Chapter 12). (o-b) A nontranscribed PRE binds specific DNA-binding proteins (e.g., PHO, PHOL, DSP1, or GAF) that are involved in the recruitment of the early PcG complex containing proteins of both PRC1 and PRC2. (c) This early PcG complex marks chromatin by E(Z)-dependent histone methylation. (d) Maintenance of the silent state occurs through interactions of the two distinct complexes, PRC1 and PRC2, in the absence of the original transcriptional repressor. Maintenance of PRC! is stabilized through binding of H3K27me3 via the chromodomain of PC. (e) PRC1 can compact chromatin, further establishing tightly condensed, silent chromatin. 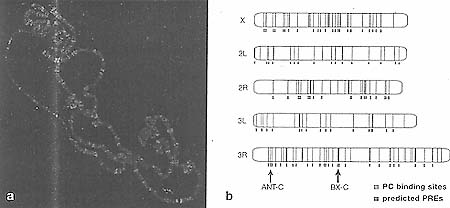 Figure 6. Targeting of PRO to PREs on Polytene Chromosomes
(a) Immunostaining of Drosophila polytene chromosomes to visualize the distribution of the PC protein. (fc>) Alignment of chromosome arms showing the overlap between predicted PRE sites on the Drosophila genome and the cytologically mapped PC-binding sites on polytene chromosomes. The two HOX gene clusters (ANT-C and BX-C) are prominent binding sites for PRCIs.
Figure 6. Targeting of PRO to PREs on Polytene Chromosomes
(a) Immunostaining of Drosophila polytene chromosomes to visualize the distribution of the PC protein. (fc>) Alignment of chromosome arms showing the overlap between predicted PRE sites on the Drosophila genome and the cytologically mapped PC-binding sites on polytene chromosomes. The two HOX gene clusters (ANT-C and BX-C) are prominent binding sites for PRCIs. 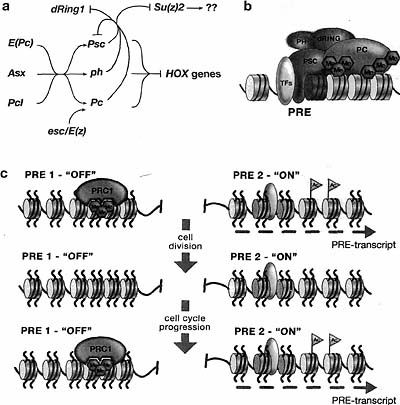 Figure 7. PRC1 Regulation and Function during Cell Division
PRE-transcript
(a) Cross-regulatory interactions among the PcG genes, as suggested from genetic evidence. E(Pc), Pel, and Asx are positive regulators of the core PRO members acting upstream. PRC2 members Esc and E(z) act as positive regulators of Pc transcription. A negative feedback by core PRC1 members on Psc and dRirtgl, as well as on Su(z)2, is observed. The fine-tuning of gene product level is probably required for well-balanced processes based on chemical equilibrium, (b) Sequence-specific transcription factors (TF) tether components of PRO to a PRE. A stable silencing complex requires anchoring of PRO via the chromodomain of PC to neighboring methylated histone tails, (c) Possible model for how differential gene expression states can be inherited. The process of intergenic transcription places positive epigenetic marks (e.g., acetylated histone tails, histone variants) at PREs that control active genes (PRE 2). All other PREs are silenced by default (PRE 1). During DNA replication and mitosis, only the positive epigenetic signal needs to be transmitted to the daughter cells, ensuring that in the next interphase intergenic transcription is restarted at PRE 2 before default silencing is reestablished at all other PREs. (a, Adapted from Ali and Bender 2004.)
Figure 7. PRC1 Regulation and Function during Cell Division
PRE-transcript
(a) Cross-regulatory interactions among the PcG genes, as suggested from genetic evidence. E(Pc), Pel, and Asx are positive regulators of the core PRO members acting upstream. PRC2 members Esc and E(z) act as positive regulators of Pc transcription. A negative feedback by core PRC1 members on Psc and dRirtgl, as well as on Su(z)2, is observed. The fine-tuning of gene product level is probably required for well-balanced processes based on chemical equilibrium, (b) Sequence-specific transcription factors (TF) tether components of PRO to a PRE. A stable silencing complex requires anchoring of PRO via the chromodomain of PC to neighboring methylated histone tails, (c) Possible model for how differential gene expression states can be inherited. The process of intergenic transcription places positive epigenetic marks (e.g., acetylated histone tails, histone variants) at PREs that control active genes (PRE 2). All other PREs are silenced by default (PRE 1). During DNA replication and mitosis, only the positive epigenetic signal needs to be transmitted to the daughter cells, ensuring that in the next interphase intergenic transcription is restarted at PRE 2 before default silencing is reestablished at all other PREs. (a, Adapted from Ali and Bender 2004.)  Figure 8. PRC2 Regulates Cell Proliferation in Mammals and Plants (a, b) Plant embryos derived from wild-type and mea mutant egg cells. MEA encodes a protein of the FIS complex and regulates cell proliferation. The giant mea embryo is much larger than the corresponding wild-type embryo at the same stage of development (late heart stage). Mutant embryos develop more slowly and have approximately twice the number of cell layers, (c, d) Normal and cancerous prostate epithelium. In the cancerous epithelium, Ezh2 expression is highly increased (labeled with an anti-Ezh2 antibody). Thus, both toss of E(Z) function in plants and overexpression of E(Z) function in humans can lead to defects in cell proliferation, (e, /) Control and RING1 overex-pressing rat la fibroblast cells. Overexpression of RING1 leads to anchorage-independent growth in soft agar, typical of neoplastically transformed cells. (a,b, Courtesy of J.-P. Vielle-Calzada and U. Gross-nikiaus; c,d, reprinted, with permission, from Kuzmichev et al. 2005 [©National Academy of Sciences; e,f, reprinted, with permission, from Satijn and Otte 1999 [©American Society for Microbiology].)
Figure 8. PRC2 Regulates Cell Proliferation in Mammals and Plants (a, b) Plant embryos derived from wild-type and mea mutant egg cells. MEA encodes a protein of the FIS complex and regulates cell proliferation. The giant mea embryo is much larger than the corresponding wild-type embryo at the same stage of development (late heart stage). Mutant embryos develop more slowly and have approximately twice the number of cell layers, (c, d) Normal and cancerous prostate epithelium. In the cancerous epithelium, Ezh2 expression is highly increased (labeled with an anti-Ezh2 antibody). Thus, both toss of E(Z) function in plants and overexpression of E(Z) function in humans can lead to defects in cell proliferation, (e, /) Control and RING1 overex-pressing rat la fibroblast cells. Overexpression of RING1 leads to anchorage-independent growth in soft agar, typical of neoplastically transformed cells. (a,b, Courtesy of J.-P. Vielle-Calzada and U. Gross-nikiaus; c,d, reprinted, with permission, from Kuzmichev et al. 2005 [©National Academy of Sciences; e,f, reprinted, with permission, from Satijn and Otte 1999 [©American Society for Microbiology].)  Figure 9. Sonic Hedgehog Signaling Maintains Proliferation/Self-renewal of Cerebellar Progenitor Cells
The Shh signaling cascade regulates both the Rb pathway and the p53 pathway via Bmil control of the pl6/p!9 proliferation checkpoint. Inhibition of Smoothened (Smoh) by the Shh receptor Patched (Ptch) results in downstream signaling in the nucleus. One part of the signal induces N-Myc, Cyclin D1, and D2, whereas the other part activates Bmil via the Gli effectors. (Adapted from Valk-Lingbeek et al. 2004.)
Figure 9. Sonic Hedgehog Signaling Maintains Proliferation/Self-renewal of Cerebellar Progenitor Cells
The Shh signaling cascade regulates both the Rb pathway and the p53 pathway via Bmil control of the pl6/p!9 proliferation checkpoint. Inhibition of Smoothened (Smoh) by the Shh receptor Patched (Ptch) results in downstream signaling in the nucleus. One part of the signal induces N-Myc, Cyclin D1, and D2, whereas the other part activates Bmil via the Gli effectors. (Adapted from Valk-Lingbeek et al. 2004.)